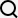
- ARAB NEWS
- 01 Aug 2025
Since 1975
日本語で読むアラビアのニュース
アビガン承認の審議継続=新型コロナ治療薬候補―厚労省

Short Url:
22 Dec 2020 02:12:44 GMT9
22 Dec 2020 02:12:44 GMT9
厚生労働省は21日、薬事・食品衛生審議会の部会を開き、抗ウイルス薬「アビガン」を新型コロナウイルス感染症の治療薬として承認するか審議した。その結果、現時点では有効性を明確に判断するのが困難として、審議の継続を決めた。企業側から現在実施中の臨床試験(治験)データの追加提出があれば、年明け以降に改めて審議する。
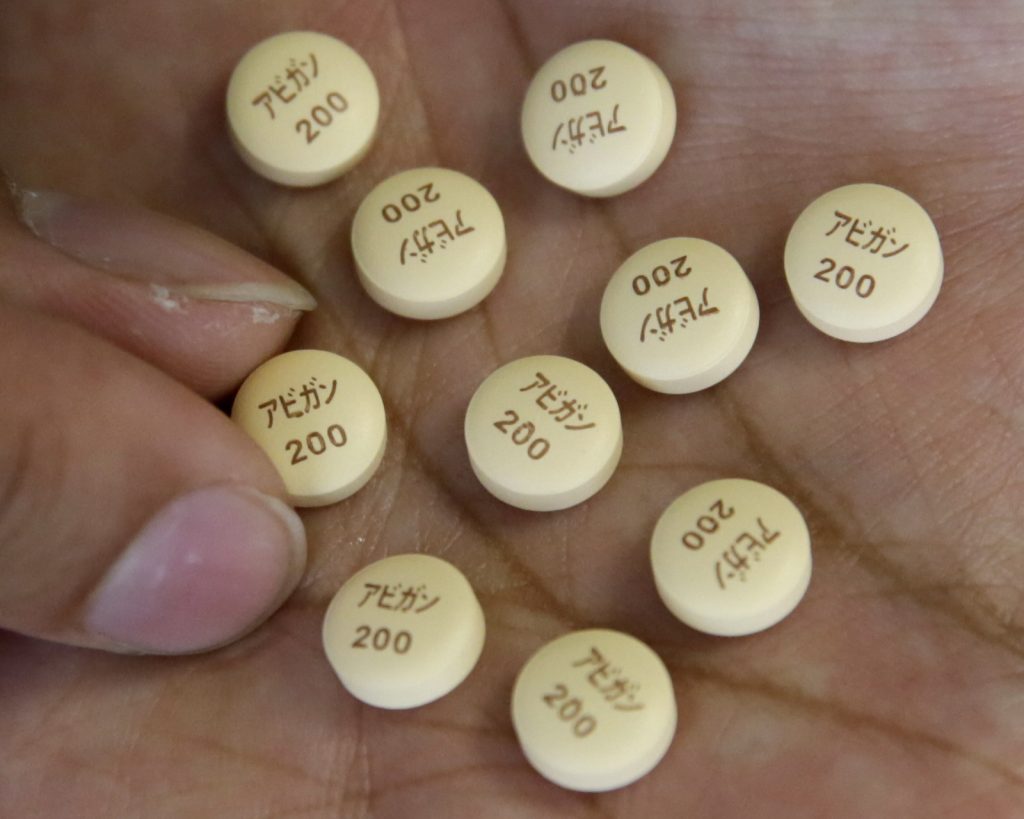
アビガンは富士フイルム富山化学(東京)が開発した新型インフルエンザ治療薬で、新型コロナでもウイルス増殖を抑える効果があるとされる。同社は治験の結果、PCR検査で陰性になるまでの期間が2.8日短縮される効果が確認されたとして、10月に承認を申請。承認されれば「レムデシビル」「デキサメタゾン」に続く国内3番目の治療薬となる。
厚労省によると、治験は医師側がアビガンと偽薬のどちらを患者に投与したか分かる方法で実施された。医師・患者の両方がどちらを投与したか分からない方法と比べ、有効性の根拠が弱いことなどが議論され、継続審議が決まったという。
アビガンは同意した患者に「観察研究」として既に投与されているが、動物実験では胎児に奇形が生じる副作用が報告されており、妊婦らには使用できない。
アビガンをめぐっては、安倍晋三前首相が国産治療薬として5月中の承認を目指す方針を表明した。その後、臨床研究での有効性確認が間に合わず同月の承認が断念された経緯がある。
富士フイルムと富士フイルム富山化学は「継続審議となったことは非常に残念。観察研究では既に1万人を超える患者にアビガンが投与されている。早期承認取得に向けて、厚労省などと審議結果を踏まえた対応を協議していく」とのコメントを出した。
JIJI Press
最新
特に人気